atualizado em 08/03/2005
Células Tronco
Hematopoiéticas
O conceito de célula tronco vem da conotação óbvia de ser a base para a formação
das estruturas mais complexas e diversas que compõem o corpo.
A definição teórica para esta entidade celular é que
uma célula tronco, primitiva por natureza, caracteriza-se pela sua capacidade de
gerar uma prole idêntica e outra diferenciada. Portanto, ela deve ter a partir
da sua divisão assimétrica, ou seja, separação desigual do conteúdo
citoplasmático, um potencial de auto-renovação e multipotencialidade (Kondo,
Wagers et al., 2003; Takano, Ema et al., 2004).
Como mencionado anteriormente, a origem da
célula-tronco hematopoiética está diretamente relacionada com a vasculogênese, a
partir do hemangioblasto (Chung, Zhang et al., 2002; De Bruijn, Ma et
al., 2002; Minasi, Riminucci et al., 2002). Inicialmente, o
reconhecimento da existência da atividade de células tronco na medula foi feito
através de experimentos de reconstituição hematopoiética em animais após
irradiação gama (Till e Mcculloch, 1961). A busca pela identidade destas células
multipotentes levou à descoberta da capacidade de expurgação dos corantes
Hoescht e Rhodamina encontrada em todas as células progenitoras. Atualmente,
sabe-se que esta atividade é exercida por intermédio das proteínas de membranas
Pgp
(glicoporteína P) e Bcrp1
(Zhou, Schuetz et al., 2001; Asakura e Rudnicki, 2002). Tecnicamente,
esta atividade caracteriza a SP
(side population). Recentemente, no entanto, foi demonstrado que esta
capacidade de expulsar estes corantes está relacionada com o grau de ativação
dos progenitores, não mais servindo como um parâmetro de isolamento para células
tronco (Uchida, Dykstra et al., 2004). Portanto, parece existir uma
heterogeneidade tanto celular quanto de atividade hematopoiética dentro das
células que compõem a SP. Dados recentes indicam que uma subpopulação SP
expressa concomitantemente o co-fator do receptor de TGFb,
endoglina. Aparentemente, são estas células SP+endoglina+
que retêm a atividade de célula tronco hematopoiética (Chen, Li et al.,
2002; Matsuzaki, Kinjo et al., 2004). No entanto, ainda não se conhece
profundamente a identidade desta população, acreditando-se que ainda haja uma
grande heterogeneidade entre elas.
Um perfil fenotípico mais estreito para a identificação
das células tronco vem sendo traçado a partir da caracterização de antígenos de
superfície. Os mais primitivos possivelmente são CD41 e AA.4. No período
embrionário, seja no saco vitelínico, seja na AGM, CD41
parece ser o primeiro parâmetro para a caracterização das HSCs. Já que, células
CD41+ derivadas de corpos embrióides, saco vitelínico ou AGM, são
capazes de gerar células hematopoiéticas CD45+ (Ferkowicz, Starr
et al., 2003; Mikkola, Fujiwara et al., 2003). Neste mesmo período,
embrionário e fetal, o antígeno AA.4 é expresso em todas as células
multipotentes hematopoiéticas e, por isto considerado um marcador pan-HSC
(Petrenko, Beavis et al., 1999)
Já no sítio hematopoiético definitivo murino, a medula
óssea, toda a atividade de célula-tronco hematopoiética está concentrada na
população identificada pela expressão simultânea de CD117+Sca-1+
e, ausência de marcadores de linhagens, denominada Lin (CD3/4/8, NK1.1, B220,
Gr-1, Mac-1 e Ter119) (Kondo, Weissman et al., 1997). Dentro desta
população Lin-CD117+Sca-1+ existem subgrupos
com características hemato-fisiológicas distintas que identificam as
subpopulações primitivas do início da cascata de diferenciação hematopoiética
(Kondo, Wagers et al., 2003), como visto na figura 1.
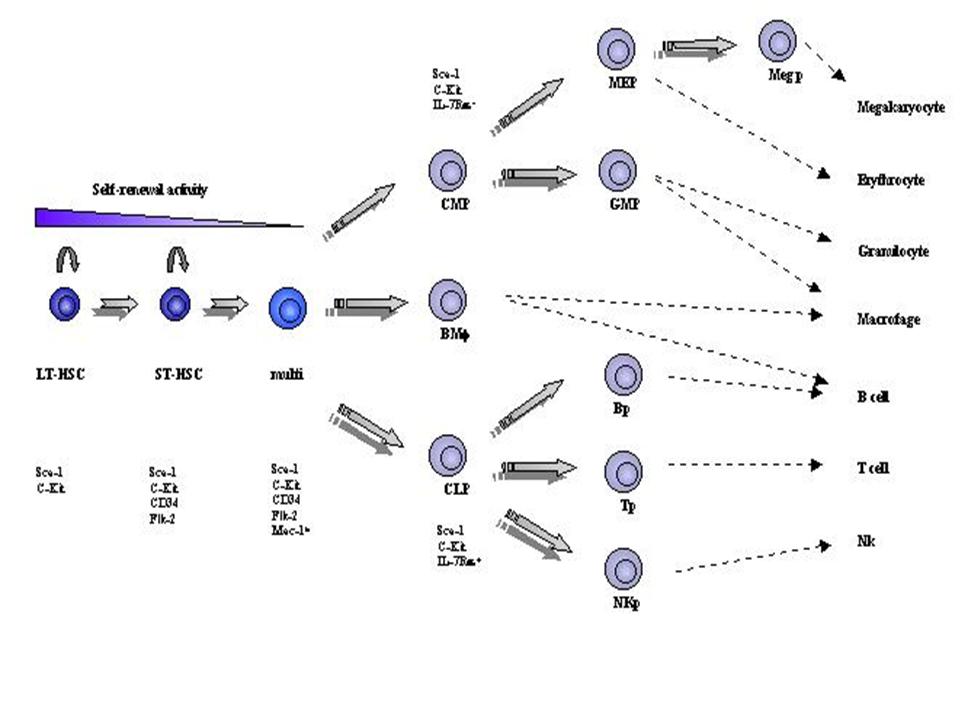

No topo da pirâmide hematopoiética está a LT-HSC
(long-term-HSC – HSC de longo prazo), capaz de reconstituir indefinidamente
sistemas hematopoiéticos de animais irradiados, identificadas como Lin-CD117+Sca-1+CD90lowFlk-2-CD127-CD34-/low.
O avanço no programa genético da hematopoiese dá origem ao segundo estágio
caracterizado pelo perfil Lin-CD117+Sca-1+CD90lowFlk-2+CD127-CD34+CD11blow.
Esta última população é denominada ST-HSC (short term-HSC – HSC de curto prazo),
pois possui capacidade de reconstituição limitada em relação às LT-HSC,
entretanto ainda demonstra atividade de auto-renovação. As populações LTs e STs
são seguidas pelas MPPs (multipotent progenitors – progenitores multipotentes).
A identidade das MPPs se dá pela expressão de Lin-CD117+Sca-1+CD90-Flk-2+CD127-CD34+CD11blow.
A partir deste último estágio de progenitores irrestritos, MPPs, ocorre uma
dicotomia linfo-mielóide, envolvendo os programas de comprometimento celular que
serão discutidos em seguida.
Notoriamente, a partir do estágio MPP, a atividade de
automanutenção dos precursores não é mais detectada. Coincidentemente, esta
atividade de auto-renovação finda com o início da expressão da tirosina quinase
receptora de citocina, Flk2 (Adolfsson, Borge et al., 2001).
Componentes da família de genes homeóticos, Hoxb4
(Kyba, Perlingeiro et al., 2002) e Hox9 (revisado em (Kondo, Wagers et
al., 2003)), parecem ser importantes para a manutenção e indução desta
atividade de auto-renovação. Além destes, FGF-1 parece participar deste fenômeno
(De Haan, Weersing et al., 2003), já que potencia a atividade LT em
células tronco transplantáveis. Existem evidências de que o fator de transcrição
GATA-2 também participa da automautenção das HSCs, uma vez que sua ausência
causa anemia severa provocada pela incapacidade de proliferação dos precursores
(Tsai e Orkin, 1997). Foi demonstrado que a citocina LIF, através da ativação de
STAT-3 (signal transducer and activator of transcription factor – fator
transdutor de sinal e ativador de transcrição), é indispensável para a
manutenção da atividade de auto-renovação das HSCs, pois induz proliferação, mas
não diferenciação celular (Niwa, Burdon et al., 1998).
O conceito de comprometimento é motivo de dúvidas em
muitas situações. O entendimento e/ou classificação deste deve ser analisado
caso a caso. Aqui, o comprometimento celular será tratado como um estado
característico de envolvimento com uma linhagem hematopoiética. Ele será
subdividido hierarquicamente em especificação e determinação. Um exemplo
hierárquico de comprometimento celular hematopoiético pode ser dado pelo fato de
que um precursor pode estar especificado para o destino linfóide ou mielóide e,
logo após, determinado à diferenciação em linfócito B.
Como a hematopoiese envolve a diferenciação de diversos tipos celulares, é
intuitivo imaginar que este processo precisa de um controle rígido e bem
coordenado, para que os programas de comprometimento sejam executados com
sucesso. Isto significa que a cascata de eventos que permite uma célula tronco
diferenciar-se em uma célula sangüínea altamente especializada segue uma
hierarquia bem definida nos diferentes níveis de desenvolvimento. Ou seja,
durante a formação das diferentes linhagens celulares existem células em
estágios intermediários, as quais ainda não estão determinadas, mas já
demonstram especificação.
Existem duas hipóteses não excludentes que explicam o processo de
comprometimento celular (Krause, 2002). Uma delas diz que a especificação
celular é definida por eventos estocásticos e, portanto imprevisíveis. A outra
admite que a influência do meio é determinante para o prosseguimento de um dado
programa gênico. Atualmente, a combinação destas duas hipóteses parece ser mais
plausível (Douagi, Vieira et al., 2002; Fisher, 2002).
Fatores de transcrição e receptores protéicos estão entre os protagonistas das
decisões celulares. Contudo, pouco é conhecido sobre a identidade e a sutileza
de ação deles. O que está bem estabelecido é que a promiscuidade genética é um
evento essencial para o comprometimento. Ou seja, as HSCs expressam
irrestritamente fatores relacionados com os programas conhecidos, linfóide e
mielóide, como GATA-3, NOTCH-1, Pax-5 e EPOR[7],
G-CSFR, PU.1 etc (Hu, Krause et al., 1997; Miyamoto, Iwasaki et al., 2002;
Terskikh, Miyamoto et al., 2003), respectivamente.
O comprometimento celular se dá a partir de um desbalanço da expressão destes
fatores intríncecos, como a determinação dose dependente de PU.1 (fator da
família Spi-1/ETS) (Dekoter e Singh, 2000). Quando em altas doses, PU.1 conduz o
progenitor para a linhagem mielóide. Já em baixas doses permite a execução do
programa linfóide, uma vez que PU.1 está envolvido no controle da expressão do
receptor de interleucina-7 (IL-7) (Dekoter, Lee et al., 2002). Esta citocina é
imprescindível para a especificação da linhagem linfóide, como será discutido
posteriormente. Outras interleucinas também influenciam o comprometimento
celular, como é o caso de IL-2. O fenótipo linfóide pode ser revertido pela
expressão forçada do receptor para IL-2 em precursores comuns (Kondo, Scherer et
al., 2000), que a partir de então geram mielócitos e não mais linfócitos.
A cascata de diferenciação hematopoiética dá origem a
duas populações fenotipicamente distintas na medula óssea adulta. Estas,
concernem os precursores comuns restritos às linhagens linfóide ou CLPs (Kondo,
Weissman et al., 1997) e mielóide ou CMPs (common myeloid precursors
– precursores comuns mielóides) (Akashi, Traver et al., 2000).
Fenotipicamente os CMPs são reconhecidos pelo perfil Lin-Sca-1-CD117+CD90-CD127-CD34+CD16low.
Já os CLPs são Lin- Sca-1lowCD117lowCD90-
CD127+CD34+CD24low Flk2+CD27+CD43+TdT+.
Curiosamente, foi demonstrado que o precursor equivalente dos CLPs no fígado
fetal, não está restrito ao potencial linfóide (Mebius, Miyamoto et al.,
2001). Esta população Lin-Sca-1lowCD117low B220-CD19+CD24+
CD43+AA.4+CD127+, neste estágio do
desenvolvimento, também é capaz de gerar macrófagos . Este fenômeno sugere que
pode existir uma imaturidade do ambiente de suporte hematopoiético hepático
fetal. O que impede que haja uma dicotomia definitiva no programa celular de um
progenitor hematopoiético. Este mesmo princípio pode ser aplicado ao fato de que
a co-cultura de precursores hematopoiéticos do saco vitelínico com o suporte do
estroma da AGM, torna estes progenitores competentes para a reconstituição
hematopoiética completa de um animal receptor (Matsuoka, Tsuji et al.,
2001), o que não acontece sem este procedimento. Sustentando assim, o papel do
microambiente para o processo de diferenciação celular.
O estágio de CLP parece não ser um estado de
determinação, já que a expressão ectópica do receptor de IL-2 pode redirecionar
sua diferenciação para a linhagem mielóide (Kondo, Scherer et al., 2000).
Isso demonstra que existe uma grande flexibilidade genética durante a
especificação linfóide. Portanto, entender os eventos estocásticos somados aos
eventos induzidos pelo nicho hematopoiético que conduzem a estes estágios
intermediários, pode nos permitir controlar o destino destes precursores em
favor de uma linhagem de interesse.
por
Hamilton da Silva Junior
voltar