atualizado em 08/03/2005
Hematopoiese: Definição e Fundamentos
A hematopoiese ou hemopoiese é a produção dos elementos
celulares e figurados do tecido sanguíneo. A atividade hematopoiética gera mais
de nove tipos celulares diferentes, divididos em: linhagem linfóide (linfócitos
T e B, células NK (natural killer) e células dendríticas linfóides); e
linhagem eritro-mielóide (macrófagos, eosinófilos, neutrófilos, mastócitos,
eritrócitos etc), a partir de uma entidade celular denominada célula-tronco
hematopoiética ou HSC (hematopoietic stem cell) (Weissman, Anderson et
al., 2001).
O surgimento do tecido sanguíneo está diretamente relacionado com o aparecimento
evolutivo do terceiro folheto embrionário, denominado mesoderma. Diversos
estudos demonstram que a deficiência de genes envolvidos na determinação
mesodérmica afeta irreversivelmente o tecido hematopoiético (revisado em (Godin
e Cumano, 2002)). No modelo animal murino o fenômeno hematopoiético é
primeiramente detectado no sétimo dia embrionário (E7)[1],
logo após o término da gastrulação. Neste período, E7, a diferenciação das
células sanguíneas está confinada ao saco vitelínico, seguindo uma hierarquia
relativamente definida, passando para a região PAS/AGM[2],
fígado fetal, baço e timo, para finalmente alojar-se na medula óssea (figura 1),
como será discutido posteriormente.

O saco vitelínico é um anexo extra-embrionário que
acompanha a parede do exoceloma e o mesoderma extra-embrionário, estando
delimitado por uma camada unicelular endodérmica (Palis e Yoder, 2001; Yoder e
Palis, 2001) (figura 2). Na ontogênese dos mamíferos, esta estrutura tem
a função primordial de estocar e fornecer elementos nutricionais essenciais para
o início do desenvolvimento até que as conexões com o organismo materno sejam
feitas através da placenta e, este último possa assumir esta função. Além disso,
é no saco vitelínico que se observa a primeira onda de produção de células
vermelhas do sangue, sempre acompanhada do fenômeno de vasculogênese. Assim são
formados a rede vascular e os elementos necessários para levar oxigenação e
nutrientes aos tecidos em formação, permitindo que o futuro embrião tenha um
desenvolvimento normal até o parto.
Como mencionado anteriormente, no modelo murino, a
hematopoiese pode ser primeiramente identificada a partir do estágio E7 (figura
1, revisado em (Dzierzak, Medvinsky et al., 1998; Cumano e Godin,
2001)), sendo totalmente esgotada no estágio E13. Neste período (E7), pequenas
protuberâncias na parede do saco vitelínico indicam os sítios da primeira onda
de diferenciação de células sanguíneas. Estas estruturas são conhecidas como
ilhotas de sangue, já que em suas porções internas pode-se detectar uma
atividade proliferativa de eritrócitos nucleados que expressam isoformas
embrionárias da hemoglobina (z,
βH1 e e)
(Stamatoyannopoulos, 2001), megacariócitos (Xu, Matsuoka et al., 2001) e
macrófagos primitivos (Shepard e Zon, 2000; El-Nefiawy, Abdel-Hakim et al.,
2002). Delimitando estas ilhotas, encontram-se células com características
morfológicas vasculares, sugerindo uma relação com a existência de um precursor
comum hematopoiético e vascular, denominado hemangioblasto (Choi, Kennedy et
al., 1998; Godin e Cumano, 2002; Minasi, Riminucci et al., 2002).
Curiosamente, as células hematopoiéticas geradas no
saco vitelínico não possuem capacidade multipotente de reconstituição
hematopoiética, já que quando transplantadas em animais letalmente irradiados,
elas não prosseguem com a hematopoiese medular óssea (Cumano, Dieterlen-Lievre
et al., 2000), sítio hematopoiético definitivo. No entanto, foi observado
que os precursores vitelínicos são capazes de dar origem a células da linhagem
linfóide a partir do dia E8 (Cumano, Furlonger et al., 1993; Lu, Wang
et al., 1996). Contudo, neste estágio outra região embrionária também possui
atividade hematopoiética, a AGM. Portanto, esta detecção de linfopoiese em E8
pode ser explicada pelo fato de que neste estágio a circulação sanguínea entre o
saco vitelínico e os tecidos embrionários já está estabelecida (Cumano, Ferraz
et al., 2001). Sugerindo que existe uma recirculação de precursores entre os
sítios hematopoiéticos extra e intra-embrionários. Estas evidências, somadas a
outras, sugerem que a produção hematopoiética vitelínica é primitiva, transiente
e distinta da hematopoiese definitiva subseqüente.
A partir do estágio E7,5-8, imediatamente após a
detecção da atividade hematopoiética primitiva do saco vitelínico, a formação de
células sanguíneas também pode ser detectada na região embrionária denominada
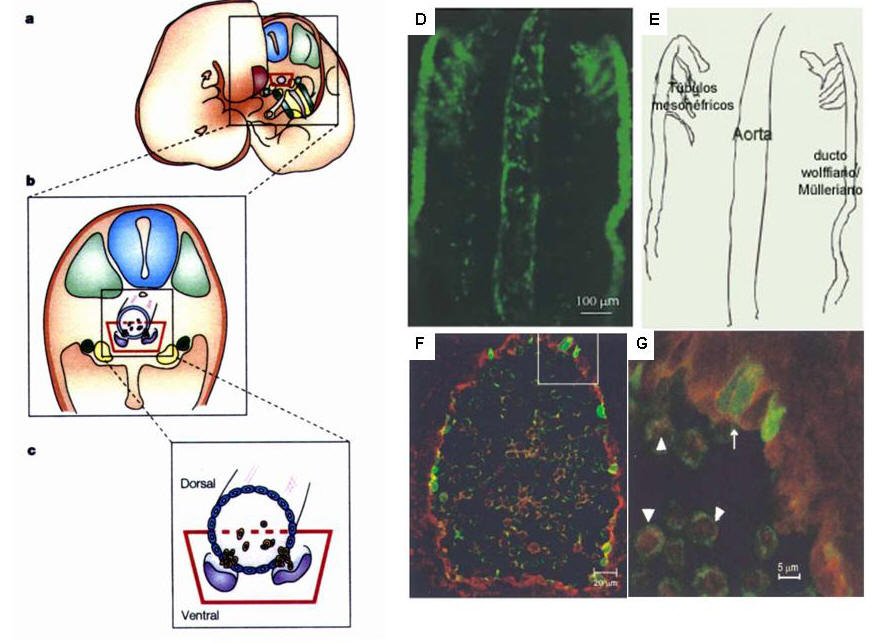
PAS (para-aorta-splanchnopleura) (Cumano, Dieterlen-Lievre et al., 2000;
Dzierzak, 2003). Esta região embrionária inclui o mesoderma esplâncnico, a aorta
dorsal, as fendas genitais, o promesonefron, o mesênquima e o mesoderma
intermediário. Estas estruturas rapidamente se organizam e tornam-se claramente
identificáveis em torno do dia E9, caracterizando a região AGM
(aorta-gonada-mesonefron)(figura 3). É na PAS/AGM que se inicia a
hematopoiese definitiva, já que os precursores isolados desta região são capazes
de dar origem a todas as linhagens celulares sanguíneas, linfóide e mielóide,
tanto in vitro (condicionalmente) quanto in vivo (Cumano,
Dieterlen-Lievre et al., 1996). Além disso, os eritrócitos produzidos
neste sítio também já possuem características adultas, como a enucleação e a
expressão das globinas α e
b
(Godin, Dieterlen-Lievre et al., 1995). Com base nestas informações,
acredita-se que esta hematopoiese na AGM é uma geração de novo de
progenitores hematopoiéticos, ou seja, independente da atividade encontrada no
saco vitelínico (Godin, Garcia-Porrero et al., 1999). Interessantemente,
assim como no saco vitelínico, o surgimento destes precursores na AGM também
está estreitamente relacionado com o aparecimento das células endoteliais (De
Bruijn, Ma et al., 2002). Isto reforça a hipótese da existência do
hemangioblasto.
Diversos fatores possuem status de essenciais para que
ocorra uma hematopoiese normal a partir do estágio E9, tanto no saco vitelínico
quanto na AGM, tais como: Tal-1,
LMO-2,
GATA-1, Flk-1,
Tie-2,
dentre de outros (Godin e Cumano, 2002). Embora existam células hematopoiéticas
multipotentes na região AGM, a hematopoiese definitiva não acontece nela (Godin,
Garcia-Porrero et al., 1999). De fato, esta região parece ser um sítio
importante para o surgimento e expansão dos precursores hematopoiéticos que irão
colonizar o próximo órgão hematopoiético embrionário, o fígado fetal (Godin,
Garcia-Porrero et al., 1999; Cumano, Dieterlen-Lievre et al.,
2000).

O desenvolvimento das estruturas teciduais,
estabelecido pela organogênese, propicia a organização dos órgãos capazes de
alojar a hematopoiese definitiva. Isto torna viável o endereçamento das células
hematopoiéticas, que passam imigrar e povoam estes tecidos. Nesta organização
dos compartimentos teciduais, a hematopoiese pode expandir em quantidade e
qualidade (Dzierzak, Medvinsky et al., 1998).
Como mencionado anteriormente, o sítio definitivo da
produção de células sanguíneas é a medula dos ossos longos e chatos. Até que
estas estruturas possuam maturidade tecidual para receber os precursores
hematopoiéticos, existe uma hierarquia aparentemente definida dos sítios
hematopoiéticos. Aquela geração de novo de precursores na PAS/AGM, imigra
em caráter transiente para o fígado fetal. Concomitantemente, seguem a via
hematopoiética auxiliar no timo. Logo após, começam a ocupar o baço e a medula
óssea. Esta migração nos estágios fetais não está completamente entendida,
embora a participação destes órgãos no processo de amadurecimento hematopoiético
seja bem aceita e estabelecida. Uma vez que, existem somente dados indiretos que
sugerem esta hierarquia (Wolber, Leonard et al., 2002).
Em camundongos, os primórdios do fígado fetal começam a
ser detectados a partir do dia E9 nas paredes do intestino delgado. O
desenvolvimento hepático conta com a participação indispensável da família de
fatores de transcrição Foxa e outros determinadores endodérmicos (Zaret, 2002).
Entretanto, ainda não se conhece nenhum evento celular ou molecular específico
da organogênese hepática. A colonização deste tecido com os precursores
hematopoiéticos inicia-se logo após a sua formação no estágio E10 (Delassus e
Cumano, 1996). Os eventos deste processo de colonização ainda não são
completamente entendidos, mas os avanços nesta área indicam uma participação
essencial das integrinas α-4 e
b-1
(Arroyo, Yang et al., 1999), assim como do complexo CXCR-4↔SDF-1
(Mcgrath, Koniski et al., 1999). Isto é sustentado pelo fato de que
precursores hematopoiéticos da AGM são incapazes de reconstituir camundongos
deficientes em SDF-1, ou em CXCR4 ou duplamente deficientes, por não receberem
sinais de endereçamento tecidual. Ou seja, a ausência da expressão de SDF-1 nas
células vasculares ou de CXCR-4 nos progenitores, ou de ambos, não permite que
haja uma reconstituição dos devidos nichos hematopoiéticos (Wright, Bowman et
al., 2002). No entanto, este complexo de endereçamento celular não parece
ser exclusivo deste estágio do desenvolvimento, já que estão envolvidos em todos
os processos hematopoiéticos de migração e homing celular já demonstrados
(Petit, Szyper-Kravitz et al., 2002; Avigdor, Goichberg et al.,
2004).
Durante esta fase inicial do desenvolvimento fetal,
E10-E13, o pool de precursores alcança um número factível para estudos da sua
caracterização fenotípica. Assim, os progenitores hematopoiéticos na transição
da AGM para o fígado fetal, passam a ser identificados pela baixa expressão de
Sca-1
e CD11b,
com alta expressão de CD117
e AA-4
(Jordan, Astle et al., 1995). Portanto, as células precursoras
identificadas como Sca-1lowMac-1lowCD117+AA-4+
no fígado fetal, são consideradas as responsáveis pela produção hematopoiética
definitiva durante a vida fetal.
Ainda existem controvérsias sobre a atividade
hematopoiética do fígado, já que faltam evidências conclusivas para afirmar se o
potencial de suporte hematopoiético do estroma hepático é passivo ou ativo. Ou
seja, acredita-se que o tecido hepático serve somente de alojamento transiente
para a produção de células do tecido sanguíneo. Apesar disso, é fato que o
tecido hepático, participa da produção das células sanguíneas tanto no período
fetal quanto em situações patológicas (Dutra, Rossi et al., 1997; Rossi,
Dutra et al., 1999; Carvalho, Arcanjo et al., 2000).
O timo é um órgão hematopoiético auxiliar, responsável
pela maturação dos linfócitos T. No modelo murino os primórdios tímicos surgem a
partir do estágio E10 na terceira bolsa faríngea, fusionado com a paratireóide.
A estruturação tecidual mínima é alcançada no estágio E13,5. A organogênese
tímica ainda não está completamente entendida e ainda gera controvérsias na
literatura (Gill, Malin et al., 2003; Manley e Blackburn, 2003; Gordon,
Wilson et al., 2004). Existem duas linhas de raciocínio para a
participação ativa dos folhetos embrionários endoderma e ectoderma na formação
tímica. A primeira propõe um modelo hipotético que se refere à necessidade de
uma atividade de condução e organização dos componentes endodérmicos que formam
o timo pelo ectoderma. Somente após o início da organização tímica, as células
ectodérmicas formariam uma cápsula em torno dos primórdios tímicos guiando a sua
maturação tecidual. Isto seria justificado com base no modelo murino atímico
nude. Estes animais têm defeitos na proliferação das células ectodérmicas e
por isso possui deficiências epidérmicas, como a ausência de pêlos. Este
fenótipo é creditado à mutação no gene FoxN1, encontrada neste modelo (Gill,
Malin et al., 2003; Manley e Blackburn, 2003).
O outro modelo sugere a origem endodérmica única do
timo. FoxN1 contrapõe a expressão de Gcm2, específico para a organogênse da
paratireóide (Manley e Blackburn, 2003; Blackburn e Manley, 2004), portanto está
envolvido na determinação do tecido tímico. Estudos mais aprofundados
demonstraram que Foxn1 está envolvido na proliferação e diferenciação das
células epiteliais tímicas (TEC – thymic epithelial cells), o que explica
a deficiência tímica no modelo nude, já que este fator está mutado. A
estruturação do tecido tímico depende de uma cascata seqüencial de outros
fatores à montante de Foxn1, como HoxA3, Pax1/9, Eya1 e Six1 (Manley e
Blackburn, 2003). A deficiência de FoxN1 causaria defeito na maturação das
células epiteliais tímicas, de origem exclusivamente endodérmica, gerando a
incapacidade de maturar os timócitos (precursores tímicos de origem
hematopoiética). Além disso, existiria uma segunda fase na organogênese tímica
dependente de linfócitos. Sem a maturação destes, não haveria como alcançar a
maturação tecidual (Manley e Blackburn, 2003; Blackburn e Manley, 2004; Gordon,
Wilson et al., 2004).
O parênquima tímico ou estroma é formado por diversos
tipos celulares envolvidos de alguma forma na maturação dos timócitos (Itoi,
Kawamoto et al., 2001; Gill, Malin et al., 2003). Células de
origem mesodérmica também participam do processo de maturação dos linfócitos T,
como células dendríticas e outros leucócitos migratórios (Anderson e Jenkinson,
2001) que compõem o estroma tímico. Este estroma está organizado em nichos, que
representam os compartimentos necessários para que ocorra a especificação e a
determinação dos progenitores, imigrantes tímicos (Lind, Prockop et al.,
2001; Petrie, 2002; 2003), como será discutido posteriormente. Estes nichos
parecem ser definidos pela presença seletiva, e ao mesmo tempo complementar, da
combinação de quimiocinas (CCL12, 19, 21 etc) e componentes de matriz
extracelular (laminina, colágenos etc) (Savino, Mendes-Da-Cruz et al.,
2002; Gill, Malin et al., 2003), que juntos compartimentam
macroscopicamente o órgão em região cortical, cortico-medular (região mais
vascularizada) e medular (Petrie, 2002) (figura 4).
A promiscuidade das interações entre os componentes de
endereçamento mencionada anteriormente, também serve para a invasão do epitélio
tímico pelos precursores linfopoiéticos. Ou seja, também existe a participação
da interação SDF-1-CXCR4 na região de entrada e saída que compõe a junção
cortico-medular do parênquima tímico. Além desta interação, a emigração tímica
parece contar com o efeito quimiotático relativamente específico de CCL19, com
seu receptor CCR7 (Ueno, Hara et al., 2002), e com o lisofosfolipídeo
acoplado à proteína G, S1P1, envolvido no desenvolvimento vascular e
expresso em linfócitos T e B (Matloubian, Lo et al., 2004). .
A atividade hematopoiética acessória do timo perdura
durante toda a vida fetal e pós-natal. Embora haja avanços na caracterização das
moléculas envolvidas na imigração e emigração tímica, a identidade fenotípica do
precursor linfóide responsável pelo componente hematopoiético que semeia o
ambiente tímico ainda não está estabelecida. A busca deste precursor pré-tímico
revelou diversos precursores celulares intermediários na cascata de
diferenciação hematopoiética e linfopoiética T, como será discutido
posteriormente.

O baço é outro órgão hematopoiético auxiliar. Ele tem
sua origem embrionária iniciada no estágio E12, a partir da fusão
endo-mesodérmica da porção externa do estômago. Ainda não existe uma clara
definição dos fatores envolvidos no processo da organogênese esplênica, mas já
foi demonstrado que os fatores Hox11, Wt1, Bapx1 e capsulina são essenciais para
a formação e manutenção da homeostasia deste desenvolvimento (Roberts, Shutter
et al., 1994; Dear, Colledge et al., 1995; Koehler, Franz et al.,
2000; Lu, Chang et al., 2000). Além de desempenhar outras funções na vida
adulta, o baço persiste com sua atividade hematopoiética, em camundongos, apesar
de estar confinada à eritropoiese.
A participação esplênica na hematopoiese parece estar
envolvida na homeostasia do trânsito fisiológico de progenitores, já que em
situações de esplenectomia ocorre um aumento da freqüência de formação de
colônias hematopoiéticas em culturas hepáticas, mas não em culturas de medula
óssea (Wolber, Leonard et al., 2002). Como no ambiente hepático, a
atividade de suporte hematopoiético pelo parênquima esplênico pode ser retomada
em situações patológicas e/ou in vitro (Tsuchiyama, Mori et al.,
1995; Wolber, Leonard et al., 2002).
A medula óssea dos ossos longos e chatos é o sítio
definitivo da hematopoiese. A formação óssea ocorre por dois processos
distintos, de acordo com a sua localização, denominados ossificações endocondral
e intramembranosa (para revisão (Kronenberg, 2003)). A gênese óssea envolve
vários fatores locais, como: BMPs,
Wnts,
FGFs,
proteínas Hedgehog, IGFs
e retinóides; e fatores sistêmicos, como: hormônio de crescimento, hormônio
tiroidiano, estrógenos, andrógenos, vitamina D e glicocorticóides. A formação
óssea atrai a vascularização que serve de porta de entrada para a imigração
hematopoiética, a qual se inicia no estágio E15. Assim como em outros sítios
hematopoiéticos a ocupação da medula óssea pelos precursores imigrantes, também
conta com o sistema de endereçamento oferecido pela interação de SDF-1/CXCR4
(Mcgrath, Koniski et al., 1999), dentre outros. A expressão de SDF-1 pelo
estroma medular parece ser importante para a contenção dos progenitores, já que
numa situação de mobilização celular este ligante sofre diminuição significativa
(Petit, Szyper-Kravitz et al., 2002)
O sucesso da atividade hematopoiética da medula óssea é
creditado às funções das células estromais ou mesenquimais. Tem sido demonstrado
que a hematopoiese medular acontece em microambientes, ou nichos, determinados
pela organização de sub-populações de células estromais (Calvi, Adams et al.,
2003; Zhang, Niu et al., 2003; Tokoyoda, Egawa et al., 2004). De
fato, o estroma parece ser responsável não só por alojar as células tronco, mas
também por regular suas atividades fisiológicas. A modulação da diferenciação
celular hematopoiética na medula óssea é conseqüência de interações contínuas
entre o estroma e as células precursoras. Estudos exaustivos têm sido realizados
com intuito de desvendar todos os componentes envolvidos neste processo.
por Hamilton da Silva Junior
Voltar
voltar