LINFOPOIESE
O desenvolvimento da linhagem linfóide conta com diversos
sítios acessórios e complementares. Mas, para efeitos didáticos este texto
focará somente as principais fontes ou tecidos linfóides primários, que são: a
medula óssea para linfócitos B e o timo para linfócitos T.
A diferenciação na linfopoiese gera diversas linhagens
celulares, como os linfócitos T, linfócitos B, células NK e células dendríticas
linfóides. Alguns fatores de transcrição são considerados indispensáveis para o
desenvolvimento da linhagem linfóide. Dentre eles estão Ikarus, Ayolos e Hélios.
Estes, são fatores de transcrição da família de “dedos de zinco” (zink finger
family factors) e têm ação com efeitos epigenéticos na linfoipoiese. Suas
atividades são efetuadas através da formação de homo e heterodímeros. Eles agem
estimulando a expressão genes linfóides específicos, assim como inibindo genes
não-linfopoiéticos (Fisher, 2002; Georgopoulos, 2002). Por isto, são
considerados genes mestres (master genes) para a linhagem linfóide.
Como discutido anteriormente, a dicotomia CMP-CLP parece ser
um efeito dose-dependente da expressão do fator PU.1. Este fator em baixas doses
permitiria a expressão de CD127 (Dekoter, Lee et al., 2002), que possui
um papel primordial na diferenciação linfóide, induzindo o desenvolvimento de
células B e expansão dos precursores T. Um outro componente fundamental para a
linfopoiese é a cadeia g
compartilhada pelos receptores das citocinas IL-2/4/7/9/15/21 (Di Santo, Colucci
et al., 1998). Sua ausência causa severa deficiência na linfopoiese
(Leonard, Shores et al., 1995), já que nesta condição não ocorre a
transdução de sinais destes receptores.
Análises clonais demonstram que apesar da restrição linfóide
dos CLPs, esta população fenotipicamente homogênea, ainda é heterogênea quanto à
expressão dos fatores de transcrição envolvidos na determinação para linfócitos
T e B. (Miyamoto, Iwasaki et al., 2002; Terskikh, Miyamoto et al.,
2003). Os CLPs expressam Pax-5, EBF,
l5 e
GATA-3, Hes-1 e o receptor NOTCH-1, que foram descritos elementos determinantes
para células B e T (Nutt, Eberhard et al., 2001), respectivamente.
Embora a cascata hematopoiética iniciada em LT-HSCs seja
direcionada para CMPs e CLPs, alguns autores defendem o fato de que o precursor
linfóide mais primitivo é o denominado ELP (early lymphoid progenitor –
progenitor linfóide inicial) (figura 5) (Allman, Aster et al.,
2002; Igarashi, Gregory et al., 2002; Yokota, Kouro et al., 2003;
Busslinger, 2004). Este precursor é identificado pela expressão de RAG-1
associada ao perfil B220+AA.4+CD4low , tanto na
vida fetal quanto na adulta. No entanto, a localização hierárquica de ELP na
cascata hematopoiética ainda não é consensual.
Ainda existem inconsistências na literatura quanto à
identificação dos programas genéticos e progenitores intermediários para as
células NK e dendríticas. Por este motivo, serão comentados somente os pontos
pacíficos para estas linhagens. As células dendríticas são entidades celulares
envolvidas na apresentação de antígenos em diversos cenários do sistema imune.
Elas podem ser divididas em dois grandes grupos: CD11c+CD8a+CD11b-
e CD11c+CD8a-CD11b+,
sendo consideradas células dendríticas linfóides e mielóides, respectivamente.
Existem evidências de que na medula óssea as células
dendríticas se diferenciam a partir de um precursor comum identificado como
CD11c+B220+CD43+CD24+Gr-1-F4/80-
(Del Hoyo, Martin et al., 2002). Em tecidos linfóides secundários as DCs
podem ser originadas tanto do CMP quanto do CLP (Manz, Traver et al.,
2001). No ambiente tímico somente os CLPs foram capazes de gerar células
dendríticas. Nenhum fator específico foi encontrado até o momento para a
designação dendrítica na cascata hematopoiética. Aparentemente, os fatores PU.1
(Guerriero, Langmuir et al., 2000), RelB e Ikaros estão relacionados com
deficiências na diferenciação das células dendríticas (revisado em (Kondo,
Scherer et al., 2001)). No entanto estes fatores possuem efeitos variados
que atingem também outras linhagens, sendo necessário um aprofundamento neste
domínio.
As células NK estão principalmente relacionadas com a
resposta imune montada numa infecção viral ou manifestação cancerosa. Elas
também podem ser geradas em diversos sítios linfóides e podem ser classificadas
em vários subgrupos funcionais, de acordo com o plantel de receptores
transmembrana expressos (Colucci, Di Santo et al., 2002). Ensaios clonais
de precursores da medula óssea murina adulta, sugerem que a população Lin-CD3-CD122+Dx-5-NK1.1-,
concentra os precursores medulares das células NK (Rosmaraki, Douagi et al.,
2001). No entanto, ainda não existe nenhuma relação hierárquica com nenhum
precursor já mencionado até aqui.
A exemplo de outros modelos, muitos elementos já são
conhecidos como essenciais para o desenvolvimento das células NK (Lian e Kumar,
2002; Colucci, Caligiuri et al., 2003). Dentre eles, estão os fatores de
transcrição Id2 (Yokota, Mansouri et al., 1999), Id3 (Heemskerk, Blom
et al., 1997) e Ets-1 (Barton, Muthusamy et al., 1998). Além deles,
as citocinas IL-15, IL-2 e IL-7 possuem um importante papel no comprometimento
dos precursores com a linhagem de células NK, já que são multiméricos e dividem
a cadeia gama ou gc
(Di Santo, Colucci et al., 1998). Embora importantes avanços tenham sido
alcançados, ainda são necessários estudos mais detalhados em relação à
hierarquia da cascata hematopoiética tanto para as células dendríticas quanto
NKs.
Os linfócitos B compõem uma entidade celular que faz parte da
imunidade celular adquirida. Estas células são responsáveis pela produção das
imunoglobulinas, que fazem parte da imunidade humoral. A diferenciação destes
linfócitos ocorre majoritariamente na medula óssea, no processo da hematopoiese.
Atualmente, muito já é conhecido sobre o desenvolvimento das células B (Douagi,
Vieira et al., 2002; Busslinger, 2004).
O comprometimento da linhagem B envolve precocemente os
fatores E12 e E47, gerados por edição alternativa do fator E2A. O balanço entre
a expressão de PU.1, junto com a sinalização de IL-7 e E2A (Kee, Bain et al.,
2002), induzem o aparecimento do primeiro elemento específico da linhagem B, o
fator EBF (early B cell factor – fator inicial de célula B). E2A e EBF
são indispensáveis para a indução do início dos rearranjos das cadeias do BCR
(Sigvardsson, O'riordan et al., 1997). Além disso, EBF também promove a
transcrição de Pax-5 (Hirokawa, Sato et al., 2003). Este último é
considerado o gene que caracteriza a determinação dos linfócitos B, pois sua
depleção reverte o comprometimento B e sua expressão forçada promove o
desenvolvimento B (Mikkola, Heavey et al., 2002; Souabni, Cobaleda et
al., 2002). Estas atividades de Pax-5 incluem a indução da expressão de CD19
(Schebesta, Heavey et al., 2002) e inibição da via de sinalização de
NOTCH, que é o análogo de Pax-5 para o comprometimento T (Souabni, Cobaleda
et al., 2002). Animais deficientes do fator Pax-5 demonstram um
aprisionamento do desenvolvimento de células B no estágio pro-B. Além disso, a
ausência condicional de Pax-5 em células B maduras, devolve a capacidade destas
células de formar monócitos (Mikkola, Heavey et al., 2002). Estes
resultados caracterizam o fator Pax-5 como um elemento essencial para manter o
fenótipo de linfócitos B e, portanto, preservar o comprometimento celular.
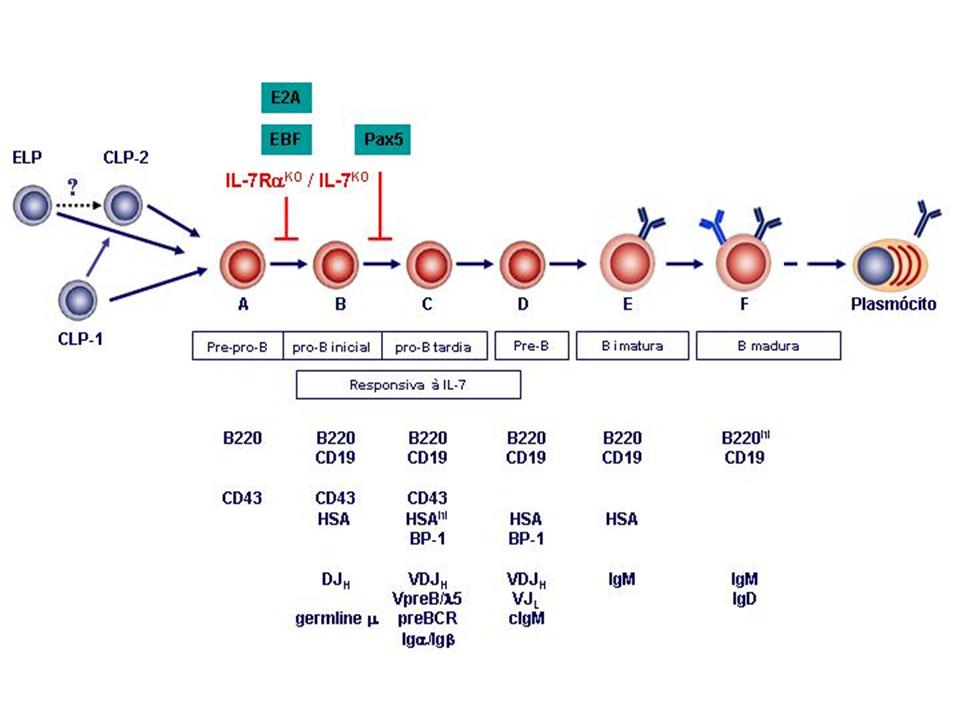
Nas últimas duas décadas, diversos estágios da cascata de
diferenciação das células B foram identificados (figura 5). A
classificação mais abrangente foi inicialmente descrita por Richard Hardy (Li,
Wasserman et al., 1996) e, recentemente revisada por Meinrad Busslinger
(Busslinger, 2004). Resumidamente, na medula óssea adulta a cascata de
diferenciação dos linfócitos B é divida em seis frações subseqüentes,
denominadas de A a F. A fração A possui um fenótipo AA.4+CD117lowCD127+B220+CD43+CD19-Flk2+BP-1-CD24-,
também identificada como células pré-pro-B. O segundo estágio, fração B ou
célula pro-B inicial, tem o fenótipo CD127+B220+CD43+CD19+BP-1-CD24+.
A fração C, ou célula pro-B tardia, é identificada fenotipicamente como CD127+B220+CD43+CD19+BP-1+CD24high.
A partir deste último, já pode ser detectado o rearranjo das cadeias precursoras
do receptor de células B ou BCR (B cell receptor). A fração D, ou célula
pré-B, é CD127+B220+CD43-CD19+BP-1+CD24+;
já a fração E, ou célula B imatura, é identificada como CD127+B220+CD43-CD19+CD24+BP-1-IgM+.
Finalmente, a fração F, ou células B maduras, é CD127+B220highCD43-CD19+CD24-BP-1-IgM+IgD+.
Como discutido anteriormente, existem precursores fetais com correspondentes na
medula óssea que possuem bipotencial B/mielóide (Cumano, Paige et al.,
1992; Montecino-Rodriguez, Leathers et al., 2001; Douagi, Vieira et
al., 2002). No entanto, ainda existe muita contradição a respeito da
importância fisiológica destes precursores bipotentes.
O desenvolvimento dos linfócitos B tem peculiaridades no período fetal que
começam a ganhar definição. De fato, existe também uma hierarquia indutiva para
as células B na ontogenia do organismo. A atividade do receptor Flk2 parece ser
responsável por uma atividade indutiva basal (Ray, Paige et al., 1996). Durante
a vida fetal e perinatal, a citocina TSLP (thymic stromal-cell derived
lymphopoitin – linfopoietina derivada do stroma tímico) é o sinal extrínseco
mais importante para a linfopoiese B (Levin, Koelling et al., 1999). Já na vida
adulta, IL-7 assume o papel de TSLP (Vosshenrich, Cumano et al., 2003).

Os linfócitos T são elementos da imunidade adquirida. Eles
são caracterizados pela expressão do receptor de células T ou TCR (T-cell
receptor) e, por de formarem diversas subpopulações com diferentes funções
no seu desempenho fisiológico. A maturação das células T é feita no timo
(Petrie, 2003), um órgão hematopoiético acessório apesar de ser considerado
classicamente um órgão linfóide primário. Por esta característica acessória,
preconiza-se que o precursor hematopoiético T venha da medula óssea, o centro da
hematopoiese. A migração do precursor T para timo é considerada um assunto
estabelecido na biologia (Petrie, 2003). No entanto, a identidade deste
precursor imigrante ainda gera divergências científicas, já que a população CLP
não pôde ser identificada no ambiente tímico. Sugerindo que há um intermediário
subseqüente aos CLPs, ou que existe uma população progenitora pré-tímica
distinta (Allman, Sambandam et al., 2003).
Como mencionado anteriormente, no ambiente fetal, ou da
medula óssea, células B220+AA.4+CD4low
expressando RAG-1, denominados ELPs (early lymphoid progenitors –
progenitores linfóides iniciais) (Igarashi, Gregory et al., 2002; Miller,
Izon et al., 2002; Yokota, Kouro et al., 2003), são capazes de
originar restritamente a linhagem linfóide in vitro e in vivo. A
existência dos ELPs é independente dos CLPs, já que animais nocautes para Ikaros
não possuem CLP, mas têm ELPs ativas (Miller, Izon et al., 2002; Allman,
Sambandam et al., 2003). Entretanto, as ELPs não parecem ser responsáveis
pelos precursores tímicos, pois também não são encontradas lá. Por este motivo,
sugere-se na literatura que ELPs possam ser pogenitores das células que
entrariam no ambiente tímico para o desenvolvimento de linfócitos T (Busslinger,
2004).
Esta busca pelo precursor tímico levou à caracterização de
uma população celular da medula óssea, denominada ETP (early T progenitors
– progenitores iniciais de linfócitos). Os ETPs, são restritos à linhagem
linfóide e podem ser identificados com o fenótipo Lin-CD117highSca-1+CD90-CD62-L+CD127-/low
(Allman, Sambandam et al., 2003; Bhandoola, Sambandam et al.,
2003). Coincidente com a atividade de comprometimento linfóide, esta população
possui expressão citoplasmática de pTa
(cadeia acessória do TCR) (Gounari, Aifantis et al., 2002). Contudo, ETPs
têm baixa eficiência de migração para o ambiente tímico (Gounari, Aifantis et
al., 2002; Allman, Sambandam et al., 2003; Martin, Aifantis et al.,
2003).
Paralelamente, foi descrito a existência de uma população da
medula óssea denominada CLP-2 (Martin, Aifantis et al., 2003) ou B220+CD117-CD127+CD19-.
Estas células possuem um certo grau da promiscuidade genética (descrita em
precursores), são restritas à atividade linfopoiética e, além disso, são capazes
de gerar uma população fenotipicamente semelhante à população DN1, discutida
abaixo.
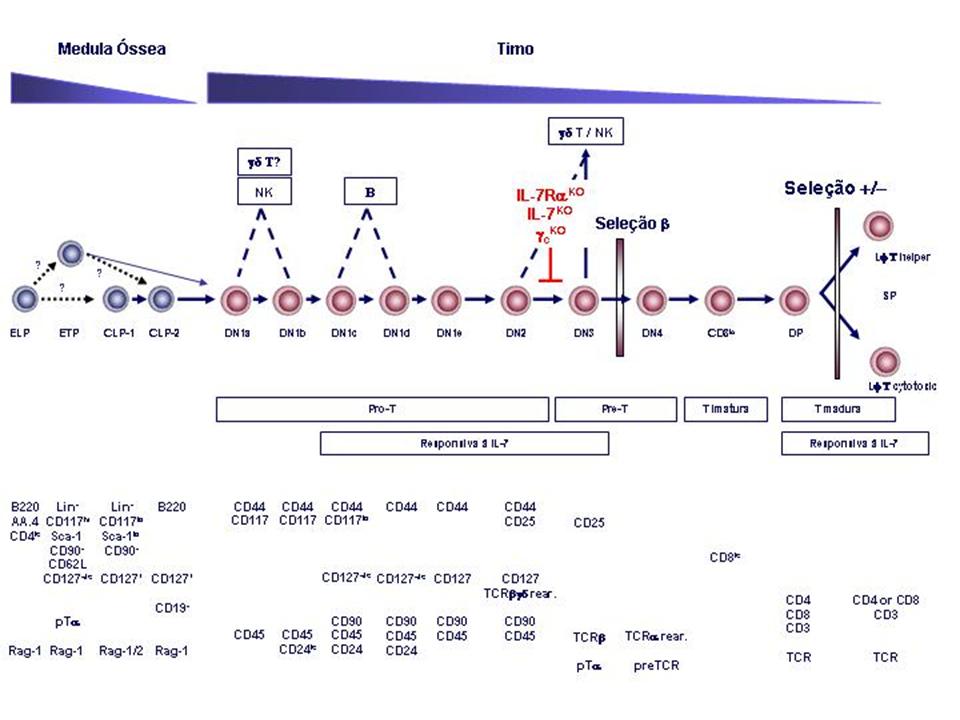
Portanto, hipoteticamente a cascata linfopoiética T extratímica pode começar com
a população ELP, Lin-CD117+CD127lo, que gera tanto ETP, quanto CLP-1,
Lin-CD117loCD127+. CLP-1 dá origem a CLP-2, B220+CD117-CD127+ e esta finalmente
alcança o ambiente intratímico, transformando-se no precursor mais primitivo
detectado no timo, denominado DN1[1]
(Martin, Aifantis et al., 2003) (figura 6). No entanto, toda esta relação
hierárquica ainda não foi experimentalmente comprovada.

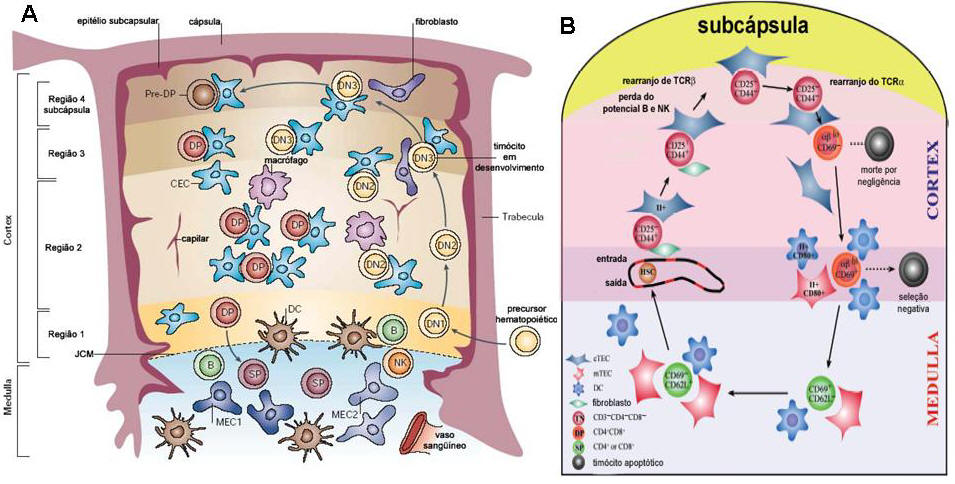
Uma vez que o precursor hematopoiético da medula óssea ganha
o espaço intratímico, ele invade o parênquima do órgão pela junção
cortico-medular (JCM), através dos vasos sanguíneos (Prockop e Petrie, 2000;
Lind, Prockop et al., 2001) (figura 4). O contato com este
microambiente, composto pelas células estromais tímicas, gera sinais indutivos
para o comprometimento celular T. Dentre estes sinais, está a interação de
NOTCH-1, expresso pelos timócitos (precursores), com os seus ligantes Delta-1 e
4 (Schmitt e Zuniga-Pflucker, 2002; Harman, Jenkinson et al., 2003a;
Hozumi, Negishi et al., 2004), presentes nas células epiteliais tímicas
(TECs). As evidências da participação da família de receptores NOTCH e seus
ligantes identificam estas moléculas como as responsáveis pelo comprometimento
da linhagem linfóide T.
A deficiência de NOTCH-1 causa formação de células B (Koch,
Lacombe et al., 2001) no timo, ao invés de linfócitos T. A expressão
forçada de Deltex-1 também causa efeito semelhante (Izon, Aster et al.,
2002). Deltex-1 é um fator citoplasmático que inibe a cascata de sinalização à
jusante de NOTCH-1. Corroborando com este fato, Pax-5 (fator determinante da
linhagem B) foi demonstrado ser um indutor de Deltex-1 (Allman, Aster et al.,
2002; Hardy, 2003; Busslinger, 2004). Por outro lado, Hes-1 que é um elemento
positivo à jusante na cascata de sinalização de NOTCH, foi demonstrado sofrer
aumento de expressão após a estimulação dos componentes citoplasmáticos de NOTCH
(Guidos, 2002). Além disso, a expressão ectópica tanto dos ligantes quanto das
porções citoplasmáticas de NOTCH gera linfócitos T extratímicos (Guidos, 2002;
Harman, Jenkinson et al., 2003b; Hozumi, Abe et al., 2003; Hozumi,
Negishi et al., 2004). Reforçando a importância da via de sinalização de
NOTCH para o comprometimento T.
Outro elemento importante para o comprometimento da linhagem
T é o fator de transcrição da família de proteínas “dedos de zinco”, GATA-3.
Animais nocautes de GATA-3 são letais, mas as células embrionárias deficientes
deste fator ou sua depleção condicional afetam diretamente a diferenciação dos
linfócitos T (Ting, Olson et al., 1996). Ou seja, as células embrionárias
derivadas deste modelo nocaute não são capazes de gerar linfócitos T mas
desenvolvem células B normalmente.
Dentro do timo existe uma dinâmica característica e bem
conhecida dos timócitos em maturação. Historicamente, os precursores tímicos
mais primitvos são classificados fenotipicamente pela ausência de CD4 e de CD8,
denominados células duplo negativas (DNs) As DNs são subdividas em DN-1 a 4, de
acordo com a combinação da expressão de CD44 e CD25 (figura 6).
Recentemente, a classificação das DN1s foi refinada ainda
mais pelo grau de comprometimento com a linhagem T (Porritt, Rumfelt et al.,
2004) (figura 6). Esta subdivisão está classificada de a a e.
Donde DN1a, são CD45+CD44+CD25-CD90-CD127-CD117+CD24-;
DN1b, CD45+CD44+CD25-CD90-CD127-CD117+CD24low;
DN1c, CD45+CD44+CD25-CD90+CD127-/lowCD117lowCD24high;
DN1d, CD45+CD44+CD25-CD90+CD127-/lowCD117-CD24+;
e finalmente DN1e, CD45+CD44+CD25-CD90+CD127+CD117-CD24-.
As populações DN1c, d e e (com cinética mais lenta)
demonstram eficiência significante em reconstituir todos os estágios da
diferenciação dos linfócitos T in vitro (Porritt, Rumfelt et al.,
2004). Mas somente DN1a e b são capazes de reconstituir a
linfopoiese tímica in vivo, após transplante singenéico. No entanto, este
fato não significa que estas subpopulações DN1s representam os precursores
pré-tímicos, mas sim que DN1a e b podem ser considerados os
precursores tímicos canônicos.
A maturação dos timócitos continua ocorrendo enquanto estes seguem em direção à
região subcapsular no cótex (Lind, Prockop et al., 2001; Porritt, Gordon et al.,
2003) (figura 7). Esta migração intratímica gera modificações fenotípicas nos
timócitos, baseadas na expressão de CD44 e CD25, dando origem aos DN2
(CD44+CD25+), DN3 (CD44-CD25+) e DN4(CD44-CD25-) (figura 6). Como mencionado
anteriormente, este movimento dentro do timo está associado às quimocinas e aos
componentes da matrix extracelular (Petrie, 2002; Prockop, Palencia et al.,
2002; Savino, Mendes-Da-Cruz et al., 2002) (figura 4), além da presença de
ligantes (ativadores e inibidores) de NOTCH (Anderson, Harman et al., 2000;
Petrie, 2000; Anderson, Robey et al., 2001; Anderson e Jenkinson, 2001). Uma vez
que os precursores alcançam o córtex, eles retornam em direção à medula do timo.
A partir de então, já começam a ser identificados pela dupla expressão de CD4 e
8, denominados timócitos duplo positivos (DPs). Quando ultrapassam a JCM em
direção à medula, estes timócitos DPs sofrem induções do microambiente para
assumirem um fenótipo simples positivo (SPs), CD4 ou 8. Daí voltam para a JCM e
emigram do ambiente tímico (figura 7), como discutido anteriormente.

por Hamilton
da Silva Junior
Voltar